作者 |東爾
9月30日,美國FDA授予泛生子(GTH.US)基于高通量測序技術(shù)(NGS)的肝細(xì)胞癌早篩液體活檢產(chǎn)品HCCscreen “突破性醫(yī)療器械”(Breakthrough Device Designation)認(rèn)定。受消息影響,泛生子美股出現(xiàn)大幅波動,一度大漲50%,當(dāng)前已經(jīng)呈現(xiàn)明顯反彈之勢。那么站在當(dāng)下關(guān)口,該如何看待這份認(rèn)定對泛生子的意義,其能夠持續(xù)吸引投資者的亮點有哪些?
1
肝癌早篩液體活檢產(chǎn)品獲美國FDA“突破性醫(yī)療器械”認(rèn)定,商業(yè)化進(jìn)程進(jìn)一步加速
此次泛生子肝細(xì)胞癌早篩液體活檢產(chǎn)品HCCscreen獲美國FDA“突破性醫(yī)療器械”認(rèn)定對于其而言意義重大,其一,在于該款產(chǎn)品的價值得到權(quán)威機(jī)構(gòu)認(rèn)可,該認(rèn)定將有望加快這一產(chǎn)品的開發(fā)和審評速度,進(jìn)一步推動商業(yè)化進(jìn)程。其二,獲得突破性醫(yī)療器械認(rèn)定對于資本市場也將更具吸引力,有利于提升公司整體估值,在融資層面釋放積極效應(yīng),進(jìn)而為公司整體發(fā)展帶來推動力。
具體而言,美國FDA的“突破性醫(yī)療器械”稱號其旨在認(rèn)定的是那些具備潛力更有效地診斷或治療危及生命的重大疾病、解決未被滿足的臨床需求的醫(yī)療器械。透過這一認(rèn)定有助于確保患者和醫(yī)療服務(wù)提供者能夠及時獲益于前沿的醫(yī)療器械;同時,對于創(chuàng)新醫(yī)療企業(yè)而言,其可助力產(chǎn)品駛上獲批的“快車道”,在與FDA的密切合作中縮短其創(chuàng)新醫(yī)療器械的上市時間。
從納入突破性醫(yī)療器械計劃的標(biāo)準(zhǔn)來看,其一是醫(yī)療器械必須能更有效地治療或診斷危及生命或不可逆轉(zhuǎn)的衰弱性疾病或病癥。其二醫(yī)療器械還必須滿足以下條件:代表突破性技術(shù);無已批準(zhǔn)的替代療法;與現(xiàn)有已批準(zhǔn)替代療法相比具有顯著優(yōu)勢;可用性符合患者的最佳利益。整體而言,要納入FDA“突破性醫(yī)療器械”并不容易,因此這也凸顯了被納入產(chǎn)品在技術(shù)層面的領(lǐng)先實力以及產(chǎn)品在市場上的稀缺性。
泛生子HCCscreen獲此認(rèn)定其主要得益于其在前瞻性隊列研究中比當(dāng)前醫(yī)療標(biāo)準(zhǔn)(即超聲檢查聯(lián)合甲胎蛋白檢測)更為卓越的臨床表現(xiàn)。據(jù)了解,泛生子的HCCscreen液體活檢產(chǎn)品核心技術(shù)源于泛生子自主研發(fā)的創(chuàng)新技術(shù)Mutation Capsule,該技術(shù)可以同時檢測外周血中游離DNA的多種甲基化和基因突變信息。目前HCCscreen檢測方法已經(jīng)在中國不同地區(qū)的多個隊列中得到驗證,達(dá)到了92%的靈敏度和93%的特異度,檢測性能優(yōu)于全球同類型肝癌早篩產(chǎn)品。此外,按照腫瘤大小分類,在初步數(shù)據(jù)中診斷出的12名肝癌中,10名患者的腫瘤小于5厘米,說明HCCscreen能靈敏地診斷出早期肝癌。
“突破性醫(yī)療器械”的認(rèn)定傳遞了積極且明確的信號,凸顯了泛生子HCCscreen在肝癌早篩領(lǐng)域的顯著優(yōu)勢,其商業(yè)化進(jìn)程加快的同時商業(yè)價值也得到進(jìn)一步放大,此外,該產(chǎn)品一旦在美獲批上市后,將被美國醫(yī)療保險和醫(yī)療補助服務(wù)中心(CMS)的聯(lián)邦醫(yī)療保險覆蓋,并被更多商業(yè)保險機(jī)構(gòu)接受采用,從而進(jìn)一步擴(kuò)大產(chǎn)品的受眾面。
作為泛生子在肝癌賽道里程碑式的一步,不僅驗證了泛生子在腫瘤基因檢測領(lǐng)域的實力,這還將有助于公司整體的估值提升,資金層面的寬裕也將推動公司研發(fā)及在研產(chǎn)品臨床注冊進(jìn)程,為公司整體的發(fā)展帶來積極效應(yīng)。
2
走在肝癌早期篩查產(chǎn)品開發(fā)的最前沿,黃金賽道的領(lǐng)頭羊
近日,諾貝爾生理學(xué)或醫(yī)學(xué)獎授予了來自英國、美國的三位科學(xué)家,表彰其發(fā)現(xiàn)丙型肝炎病毒,該病毒是肝癌的一個主要致病因素。肝癌作為全球第六大常見癌癥,在所有癌癥中致死率排名第四,數(shù)據(jù)顯示,全球每年新發(fā)肝癌病例85.4萬例,其中有42.2萬例位于中國,占比高達(dá)55%,同時我國也是肝癌死亡病例最多的國家,占世界肝癌死亡病例的45%到50%。
此外,根據(jù)Frost&Sullivan; 2019年調(diào)研數(shù)據(jù),我國約有1.2億肝癌高危人群,其中約7400萬為乙肝病毒攜帶者。而在美國,肝癌是排名第五的致死癌癥,且患病群體每年以2%-3%的速度增長。2020年美國新增肝癌預(yù)計為4.28萬例,死亡3.01萬例。
肝細(xì)胞癌(HCC)是肝癌中最常見的類型,占比在85–90%,其主要發(fā)生在慢性肝炎(HCV和HBV)或飲酒導(dǎo)致的肝硬化患者中,通常確診時已處于晚期階段。根據(jù)相關(guān)統(tǒng)計,只有44%的肝癌患者在早期得到診斷,而晚期肝癌患者的五年存活率低于16%。不過,如果能夠?qū)Ω伟┻M(jìn)行早期篩查和治療,則可以將患者的5年存活率提高至70%。因此,這也意味著,對肝癌進(jìn)行早期診斷,早期發(fā)現(xiàn)是一項具有較大前景的醫(yī)療需求。
從當(dāng)前市場上的情況來看,肝癌早篩通常聯(lián)合甲胎蛋白檢測(AFP)和肝臟超聲檢查對肝癌高危人群進(jìn)行定期篩查,發(fā)現(xiàn)異常再進(jìn)一步考慮CT或磁共振檢查,但AFP聯(lián)合超聲檢測對早期肝癌的診斷靈敏度較低,僅有60%左右,而歐洲肝臟研究協(xié)會和美國肝病研究協(xié)會已不再推薦測定AFP水平來診斷肝癌。另由于AFP聯(lián)合超聲的篩查方法對病人依從性要求較高,可及性遠(yuǎn)遠(yuǎn)無法達(dá)到臨床要求,如在美國此方法篩查率不足20%,在中國更是僅有個位數(shù),因此,產(chǎn)品檢測性能和可及性都制約了目前臨床篩查方法的有效實施。
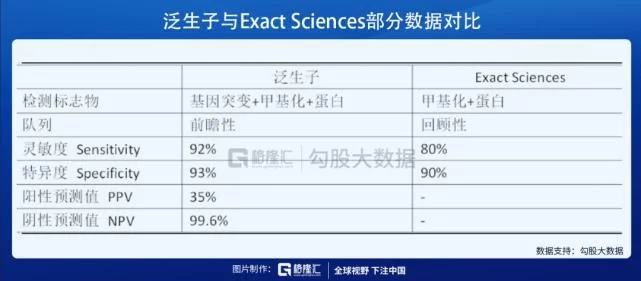
此外,全球市場上另有Exact Sciences等公司在開發(fā)針對肝癌的液體活檢早篩技術(shù)。根據(jù)全球老牌早篩公司Exact Sciences的多中心、回顧性研究,其采用的甲基化聯(lián)合蛋白質(zhì)的肝癌早篩檢測靈敏度為80%,特異性為90%,低于泛生子的前瞻性研究數(shù)據(jù)(靈敏度92%、特異度93%)。一般而言,由于各方面的原因,前瞻性研究的數(shù)據(jù)往往很難取得優(yōu)于回顧性研究的成績。而泛生子HCCscreen前瞻性研究數(shù)據(jù)則表現(xiàn)出了不亞于同類產(chǎn)品回顧性研究數(shù)據(jù)的表現(xiàn),這為其作為現(xiàn)有超聲+AFP的替代性方案——而非補充性技術(shù)——在臨床中取得更加優(yōu)異的表現(xiàn)帶來了期待。
由此而言,泛生子的HCCscreen技術(shù)可以說走在了肝癌篩查的最前沿,其當(dāng)屬于全球一流的肝癌篩查技術(shù)。而從價格層面來看,此前泛生子CEO王思振曾表示,泛生子的目標(biāo)是使其HCCscreen早期肝癌篩查產(chǎn)品的價格足夠低,以便大眾能夠獲得并負(fù)擔(dān)得起。值得一提的是,目前該產(chǎn)品已在中國以實驗室自建項目(LDT)的方式開始商業(yè)化。隨著后續(xù)產(chǎn)品進(jìn)一步面向市場,龐大的需求有望為其業(yè)績增長帶來支撐。
可見,憑借領(lǐng)先的技術(shù)優(yōu)勢,泛生子肝細(xì)胞癌早篩液體活檢產(chǎn)品有望作為現(xiàn)有臨床檢測技術(shù)的重要替代,在肝癌檢測領(lǐng)域打開市場空間。由于肝癌在全球范圍內(nèi)呈現(xiàn)出高確診率和死亡率,會加速肝癌早篩創(chuàng)新技術(shù)和產(chǎn)品的進(jìn)一步普及,而在此背景下,泛生子將憑借領(lǐng)先的檢測技術(shù)性能和產(chǎn)品商業(yè)化進(jìn)程,站穩(wěn)國內(nèi)乃至全球市場的頭部位置。
3
扎根廣闊藍(lán)海市場,不斷鞏固龍頭優(yōu)勢地位
從市場規(guī)模來看,腫瘤早篩早診擁有廣闊的市場空間, 根據(jù)中國臨床腫瘤學(xué)會(CSCO)指南的定義,預(yù)計2023年中國約有1.20億肝癌高風(fēng)險人群,9580萬肺癌高風(fēng)險人群,及2.46億胃癌高風(fēng)險人群,假設(shè)單位檢測價格在200美元/人份,癌癥早篩在家庭年收入20000美元以上的家庭中的滲透率為30%,則中國肝癌、肺癌、胃癌早篩市場規(guī)模分別約為72億美元、57億美元及148億美元。當(dāng)前在國內(nèi)醫(yī)生意識和患者篩查早期癌癥檢出率仍然相對較低,隨著市場教育及普及不斷加大,未來整個市場空間有望進(jìn)一步打開。
除了癌癥早篩領(lǐng)域外,泛生子實際上打造了一個靈活的一站式分子檢測解決方案,覆蓋癌癥治療全周期,包括癌癥早期篩查、診斷與監(jiān)測以及藥物研發(fā)服務(wù),除中國已擁有的5家醫(yī)學(xué)檢驗實驗室提供LDT服務(wù)外,美國馬里蘭的CLIA實驗室也正在建設(shè)中,還有7款I(lǐng)VD(In Vitro Diagnosis,體外診斷)產(chǎn)品獲批應(yīng)用于臨床,并另有7款已進(jìn)入臨床注冊報證階段,位列行業(yè)首位。
作為專注癌癥精準(zhǔn)醫(yī)療領(lǐng)域的行業(yè)領(lǐng)先者,泛生子建立了一站式腫瘤精準(zhǔn)醫(yī)學(xué)治療平臺,提供一整套服務(wù)和產(chǎn)品,憑借在廣闊藍(lán)海賽道的領(lǐng)先優(yōu)勢,公司的業(yè)績增長迅猛。2017-2019 年營收年復(fù)合增長率接近80%;毛利年復(fù)合增長率達(dá)132%;由于公司還處在研發(fā)及市場強投入期,公司并未盈利,不過從長遠(yuǎn)來看,龐大的市場空間及優(yōu)勢布局之下,占據(jù)領(lǐng)導(dǎo)地位的泛生子其發(fā)展前景可觀。據(jù)了解,目前公司正在開發(fā)涵蓋多種流行癌癥類型的高通量測序( NGS) 平臺和基因檢測,以尋求 NMPA 注冊。隨著后續(xù)產(chǎn)品與服務(wù)的市場滲透率不斷加深,公司的業(yè)績有望進(jìn)入高速增長階段。
癌癥作為已經(jīng)成為嚴(yán)重威脅中國人群健康的主要公共衛(wèi)生問題之一,當(dāng)前政策層面也在大力推動腫瘤早篩早診,早在2018年底,國家衛(wèi)生健康委首次發(fā)布腫瘤早篩相應(yīng)的規(guī)范性標(biāo)準(zhǔn)《18種癌癥診療規(guī)范》,將18種癌癥的體外診斷進(jìn)行規(guī)范。隨著政策層面的推動,整個行業(yè)也將有望不斷朝向良性規(guī)范化發(fā)展,對于在這一領(lǐng)域有成熟技術(shù)和經(jīng)驗的企業(yè)也將獲得更好的發(fā)展環(huán)境,形成強者恒強的發(fā)展之勢頭。泛生子也將在這一趨勢之中享受市場及政策帶來的紅利。
4
小結(jié)
此次泛生子HCCscreen獲得美國FDA“突破性醫(yī)療器械”認(rèn)定,體現(xiàn)了美國監(jiān)管機(jī)構(gòu)對其研發(fā)實力的高度認(rèn)可,也有助于其進(jìn)一步深化與美國FDA的關(guān)系,為后續(xù)產(chǎn)品的商業(yè)化打開快捷通道。以此為契機(jī),泛生子已啟動美國和中國兩地的肝癌早篩產(chǎn)品的注冊申報工作,預(yù)計將于未來2-3年內(nèi)獲批上市,這將進(jìn)一步鞏固公司在肝癌早篩領(lǐng)域的先發(fā)優(yōu)勢。而拿下作為全球醫(yī)療器械創(chuàng)新產(chǎn)品審批風(fēng)向標(biāo)的美國FDA“突破性醫(yī)療器械”認(rèn)定,也證明了泛生子在癌癥早篩領(lǐng)域具有全球性的技術(shù)研發(fā)能力和商業(yè)競爭力,并將進(jìn)一步推動其產(chǎn)品的全球化發(fā)展,擁抱更大的全球市場,并帶動國內(nèi)乃至全球癌癥早篩行業(yè)進(jìn)入發(fā)展快車道。
從整個癌癥早篩市場來看,泛生子當(dāng)前正不斷加快研發(fā)投入,并取得了顯著的成績,商業(yè)化成果及能力不斷得到驗證,其扎根藍(lán)海市場,在優(yōu)質(zhì)核心賽道卡位優(yōu)勢點位,在資本市場上兼具成長性和稀缺性特征。此次獲得FDA認(rèn)定有望成為公司行情發(fā)展的重磅催化劑,驅(qū)動整體估值走上向上通道,公司價值起跑的“發(fā)令槍”或已經(jīng)打響。

 APP--雙知雙行:
APP--雙知雙行: